FAQ
1. 产品放行前的质控有哪些?
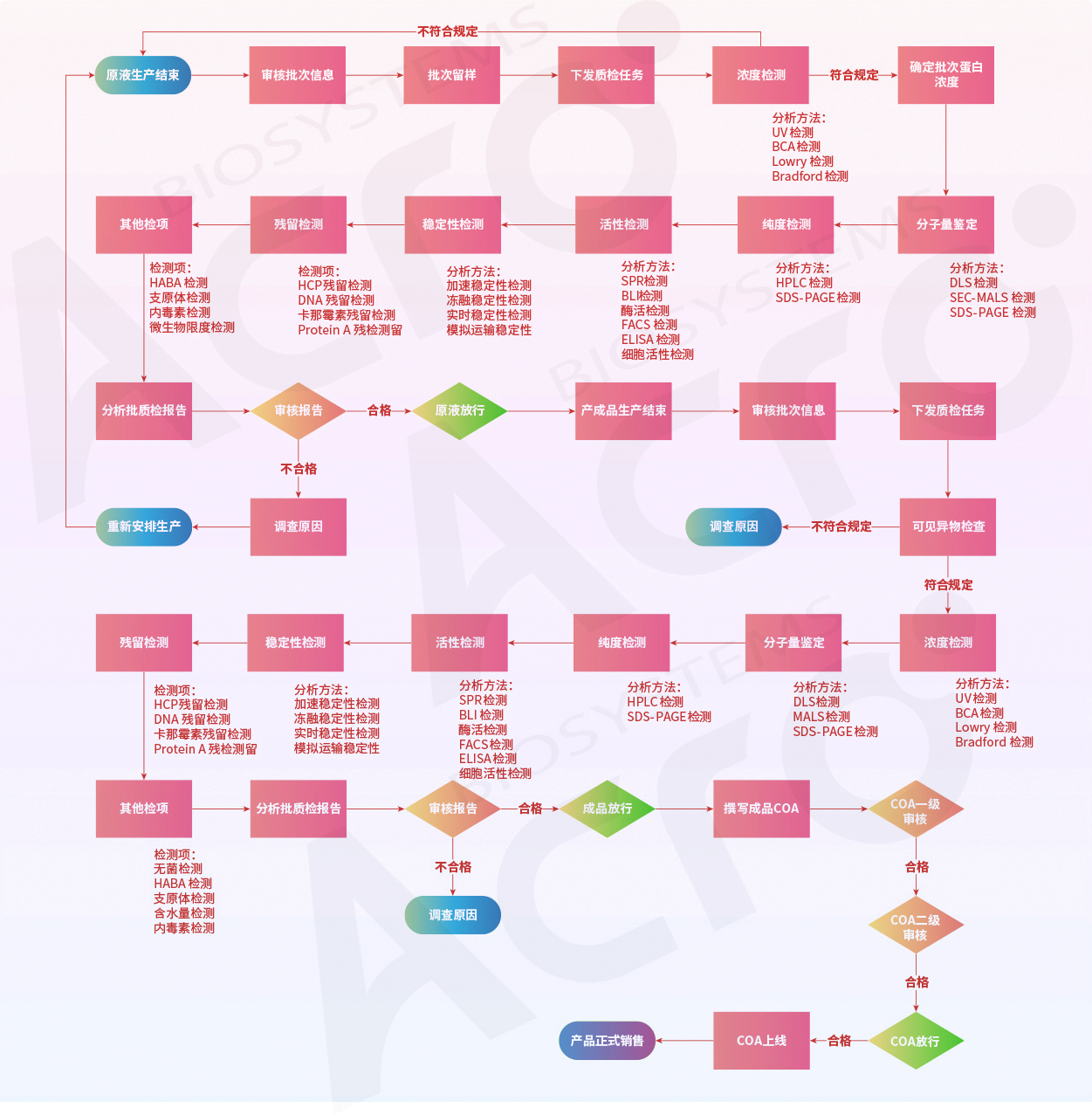
ACROBiosystems百普赛斯搭建了严格的质量控制体系,在质量控制方面,从生产原液到产成品,质量严格把关,使用多达20+项先进检测技术,历经30+次检测,4次审核,3次放行的全面质检流程。
2. 什么是DMF?DMF归档有批准证书吗?ACROBiosystems百普赛斯产品是否在FDA申请了DMF备案?DMF备案的产品有哪些?
(1)DMF是“Drug Master File”的简称,译为“药品主文件”是关于产品化学、生产和质量控制(CMC,Chemistry, Manufacturing and Controls)信息的一套完整文件资料,内容包括产品的一般信息、生产工艺、杂质研究、稳定性等方面的资料和数据。包括涉及该产品的核心机密,如详细工艺描述、关键工艺参数、完整的物料信息等。DMF的状态有两种: “A”=Active:激活状态,表示该DMF已获得归档号/登记号/备案号并被正常维护,可用; “I”=Inactive:未激活状态,表示该DMF已被持有人或FDA关闭,不可用。
(2)没有证书,但会在FDA官网予以公示,所有人均可检索到。
(3)是的,ACROBiosystems百普赛斯于2020年7月首次实现重组蛋白试剂的DMF备案,是业内第一家重组蛋白通过FDA的DMF备案的公司。点击链接了解更多DMF备案详情
(4)到目前为止共对33个货号的产品进行了DMF备案,未来还将持续对更多产品进行DMF备案。
3. ACROBiosystems百普赛斯如何确保产品质量?
产品质量控制是一个综合的控制体系,ACROBiosystems百普赛斯的控制策略包括:对原材料的控制和检验;按照规范的SOP对中间品、半成品和终产品进行测试等,以确保产品质量自始至终得到有效控制和保证。产品放行由有资质的授权人员进行操作,供应商审核根据需要进行。 另外也会通过监控产品投诉、不合格品、纠正和预防措施计划等监控质量控制的有效性。
4. ACROBiosystems百普赛斯 RUO和GMP产品之间的区别?
| 验证标准 | 验证结果 | |
|---|---|---|
| 产品种类 | 多数靶点蛋白产品 | GMP级别细胞因子/酶/抗体等产品 |
| 应用 | 仅供研究使用 | 为满足临床阶段需求而设计,用于商业化生产 |
| 质量体系 | ISO9001/ISO13485质量体系认证 | ISO+GMP质量体系 |
| 生产 | 普通级别厂房生产 | GMP级别洁净厂房生产 |
| 多数为瞬转 | 稳定株(外检) | |
| 多数AOF原材料 | AOF原材料 | |
| 关键辅料非药用级 | 关键辅料药用级 | |
| 经过除菌过滤 | 经严格二级除菌过滤 | |
| 手动罐装 | B+A全自动灌装 | |
| 无病毒去除/灭活工艺 | 病毒去除/灭活步骤 | |
| 检测 | 无菌/支原体检测非必检项(仅适用于部分产品) | 无菌/支原体检测 |
| 内毒素非必检项 | 内毒素控制及检测 | |
| 分析方法、检测仪器未做严格验证 | 关键分析方法、检测仪器严格验证 | |
| 无全面安全性相关检测 | 全面安全性检测 (病毒/异常毒性/急毒/残留DNA/HCP检测/残留抗生素检测) | |
| 文档 | 有限法规支持文件(COA, COO, MSDS等文件) | 全面的两级法规支持文档RSF |
如需填写供应商调查表或出具质量声明,请点击按钮联系我们!
quality@acrobiosystems.com